一、实验目的:
1、掌握HCL标准溶液的配制和标定方法
2、学会标准溶液浓度的调整方法
3、熟练掌握称量和滴定操作
二、实验内容
1、实验仪器
仪器:全自动电光分析天平 1台
(1)称量瓶 1只
(2)试剂瓶 1000ml 1个
(3)锥形瓶 250ml 3个
(4)酸式滴定管 50ml 1支
(5)量筒 50mL 1只
试剂:①浓盐酸 (密度1.19);②甲基橙0.1%(m/v);③基准物质:无水碳酸钠(事先烘干)
2、实验原理
用基准物质标定
常用来标定HCL 溶液的基准物质有无水碳酸钠(Na2CO3)或硼砂(Na2B4O7.10H2O)。
本实验采用无水Na2CO3标定HCL溶液。
用无水Na2CO3标定HCL溶液的反应分两步进行:
Na2CO3+HCL====NaHCO3+NaCL
Na2CO3+HCL==== NaCL+H2O+CO2↑
反应完全时,PH值的突跃范围是5.3~3.5,(化学计量点时,溶液PH值约为3.89),可选用甲基橙为指示剂,但因溶液中H2CO3的影响,甲基橙由黄色变为橙色不易观察,终点会提前出现。为减少滴定终点误差,用HCL滴定Na2CO3,当滴至甲基橙刚变橙色时(约化学计量点前1%),暂停滴定,将溶液加热煮沸,除去生成的CO2,溶液又呈黄色,冷却溶液至室温,再继续用HCL溶液滴定至橙色终点。
3、实验内容
1)、c(HCL)=0.1mol.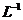 HCL溶液的配制
HCL溶液的配制
用10mL洁净量筒量取浓HCL(12 mol.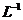 )4.5mL,倒入500mL烧杯中,加入300mL蒸馏水,摇匀,再稀释至500mL, 移入试剂瓶中,继续摇匀,贴上标签,待标定.
)4.5mL,倒入500mL烧杯中,加入300mL蒸馏水,摇匀,再稀释至500mL, 移入试剂瓶中,继续摇匀,贴上标签,待标定.
2)、 c(HCL)=0.1mol.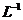 HCL溶液的标定
HCL溶液的标定
(1) 称量法 用称量瓶按差减法准确称取基准物质无水碳酸钠0.15~0.2克三份,分别放入250mL锥形瓶中,各加入25mL蒸馏水使其溶解,加甲基橙指示剂1滴, 用HCL溶液滴至溶液由黄色变为橙色即为终点(临近终点时,可将溶液煮沸除去CO2,冷却后继续滴定), 记下HCL溶液的体积,平行测定三次。
(2)移液法 因无水碳酸钠吸水性强,通常采用移液法。
移液法 用减量法准确称取无水碳酸钠1.2~1.5克, 置于250mL烧杯中,加50mL水搅拌溶解后,定量转入250mL容量瓶中,用水稀释至刻度,摇匀,作为标准溶液备用.
用移液管移取25.00mL上述Na2CO3标准溶液于250ML锥形瓶中,加入1滴甲基橙指示剂,用HCL溶液滴定至溶液刚好由黄色变为橙色即为终点,记下所消耗的HCL溶液体积.平行测定三次。
4、实验记录:用Na2CO3标定HCL
| 记录项目/序次 |
1 |
2 |
3 |
| 称量瓶+ Na2CO3质量 (倾样前),g |
|
|
|
| 称量瓶+ Na2CO3质量 (倾样后),g |
|
|
|
| Na2CO3质量,g |
|
|
|
| HCL溶液终读数,ml |
|
|
|
| HCL溶液初读数,ml |
|
|
|
| HCL溶液体积,ml |
|
|
|
| c(HCL) |
|
|
|
| 平均浓度 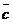 (HCL) (HCL) |
|
| 平均偏差 |
|
5、结果计算
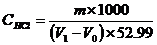
式中: m—基准无水碳酸钠的质量,g;
V1—盐酸溶液的用量,ml;
V0—空白试验中盐酸溶液的用量,ml;
52.99—1/2 Na2CO3摩尔质量,g/mol
CHCL—盐酸标准溶液的浓度,mol/L.
三、注意事项
1.实验前预习有关电子天平的相关内容及操作。
2.·实验前预习有关滴定分析的基本操作。
3. 滴定时,加入HCl溶液应缓慢,同时摇动锥形瓶,临近终点时应剧烈摇动,避免因CO2气泡冲出而致损失。溅在锥形瓶壁上的溶液,应用洗瓶水冲下去。
四.思考题
1. 配制HCL标准溶液能否采用直接配制法?为什么?
2. 配制HCL标准溶液时, 量取浓HCL的体积是怎样计算的?
3. 以Na2CO3基准物标定HCL溶液,需称取Na2CO3的质量如何计算?若用稀释法标定,需称取Na2CO3的质量又如何计算?
4. 以Na2CO3基准物标定HCL溶液浓度,可否选用酚酞作指示剂?其标定浓度结果如何?
5. HCL标准溶液大于或小于所需浓度时,如何计算加水体积和加浓HCL的体积。
6. 标定HCL溶液的基准物除Na2CO3外, 还可用什么基准物?有何优缺点?选用何种指示剂?
7. 除用基准物质标定HCL溶液外,还可用什么方法标定HCL溶液?
8. 无水Na2CO3保存不当,吸水1%,用此基准物质标定盐酸溶液浓度时,其结果有何影响?用此浓度测定试样,其影响如何?