实验类型: 综合 要求:必修 学时:8
一、实验目的:
1.了解硫酸四氨合铜(Ⅱ)的制备步骤并掌握其组成的测定方法。
2.掌握蒸馏法测定氨的技术。
二、实验原理
硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4·H2O)为深蓝色晶体,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。本实验以硫酸铜为原料与过量的NH3·H2O反应来制备:
[Cu(H2O)5]2+ + 4NH3 + SO42- = [Cu(NH3)4]SO4·H2O + 5H2O
硫酸四氨合铜溶于水,不溶于乙醇,因此在[Cu(NH3)4]SO4溶液中加入乙醇,即可析出[Cu(NH3)4]SO4·H2O晶体。
[Cu(NH3)4]SO4·H2O中的Cu2+ 、SO42-及NH3含量可以用吸光光度法、重量分析法、酸碱滴定法分别测定。
[Cu(NH3)4]SO4·H2O在酸性介质中被破坏为Cu2+及NH4+,加入过量NH3可以形成稳定的深蓝色配离子[Cu(NH3)4]2+。根据朗伯-比尔定律:
A =kcb
式中:A为吸光度;k为有色溶液的摩尔吸收系数;c为试液中有色物质的浓度;b为液层的厚度。
配制一系列已知铜浓度的标准溶液,在一定波长下用分光光度计测定[Cu(NH3)4] 2+溶液的吸光度,绘制标准曲线。由标准曲线法求出Cu2+离子的浓度,从而可以计算出样品中的铜含量。
[Cu(NH3)4]SO4·H2O在碱性介质中被破坏为Cu(OH)2和NH3。在加热条件下把氨蒸入过量的标准溶液中,再用标准碱溶液进行滴定,从而准确测定样品中的氨含量。
三、主要仪器和试剂
1. 仪器:台秤、研钵、布氏漏斗、抽滤瓶、电子天平(0.1mg)、722分光光度计、吸量管(5mL、10mL)、容量瓶(50 mL、100 mL)、比色皿(2cm)、滴定管(酸式、碱式 25mL)、 锥形瓶(100mL)
2. 试剂:碱:NH3·H2O(1:1)、CuSO4·5H2O固体、H2SO4(3 mol·L-1) HCl标准溶液(0.1 mol·L-1)、NaOH(10% 0.1 mol·L-1)、NH3·H2O(2 mol·L-1)、标准铜溶液(0.0500 mol·L-1)、乙醇(95%)、酚酞(0.2%)
四、实验步骤
1.硫酸四氨合铜(Ⅱ)的制备
在小烧杯中加入NH3.H2O(1:1)30mL,在不断搅拌下慢慢加入精制CuSO4.5H2O10g,继续搅拌,使其完全溶解成深蓝色溶液。待溶液冷却后,缓慢加入35mL乙醇(95%),即有深蓝色晶体析出。盖上表面皿,静置约15min,抽滤,并用1:1 NH3.H2O-乙醇混合液(1:1氨水与乙醇等体积混合)淋洗晶体两次,每次用量约2~3mL,将其在60℃左右烘干,称量。
按CuSO4.5H2O的量计算[Cu(NH3)4]SO4.H2O的产率。评价产品的质和量,并分析原因。
2. 硫酸四氨合铜(Ⅱ)的组成测定
1). 铜含量测定
(1)[Cu(NH3)4] 2+的吸收曲线的绘制
用吸量管吸取0.0500 mol.L-1标准铜溶液0mL,2.0mL,4.0mL,分别注入三个50mL容量瓶中,加入10.00mL2mol.L-1NH3.H2O,用蒸馏水稀释至刻度,摇匀。以试剂空白溶液(即不加标准铜溶液)为参比溶液,用2cm比色皿,用分光光度计分别测定500~680nm时的吸光度。以吸光度为纵坐标、波长为横坐标,绘制吸收曲线,求出[Cu(NH3)4] 2+的最大吸收波长(λmax)。
(2)标准曲线的绘制
用吸量管分别吸取0.0500 mol.L-1标准铜溶液0mL、1.00mL、2.0mL、3.0mL、4.00mL、5.0mL,注入六个50mL容量瓶中,加入10mL2.0 mol.L-1 NH3.H2O溶液后,用蒸馏水稀释至刻度,摇匀。以试剂空白溶液为参比溶液,用2cm比色皿,在[Cu(NH3)4] 2+的最大吸收波长(λmax)下,分别测定它们的吸光度。以吸光度为纵坐标,相应的Cu2+含量为横坐标,绘制标准曲线。
(3)样品中Cu2+含量的测定
准确称取样品0.2~0.3g于小烧杯中,加5mL水溶解后,滴加6mol.L-1H2SO4至溶液从深蓝色变至蓝色(表示络合物已解离),将溶液定量转移至100mL容量瓶中,加入蒸馏水稀释至刻度,摇匀。准确吸取样品10.00mL置于50mL容量瓶中,加10.00mL2.0 mol.L-1 NH3.H2O,用蒸馏水稀释至刻度,摇匀。以试剂空白溶液为参比溶液,用2cm比色皿,在[Cu(NH3)4] 2+最大吸收波长(λmax)下测定其吸光度。从标准曲线上求出Cu2+含量,并计算样品中铜的含量。
3. 氨含量的测定
氨含量的测定在简易的定氮装置中进行,如图所示。测定时先准确称取0.25~0.30g样品置于锥形瓶中,加入80mL水溶解,然后加入10.00mL10%NaOH溶液。在另一锥形瓶中准确加入30~35mL0.5 mol.L-1HCl溶液。按图按装装置,漏斗下端固定于一小试管,试管中注入3~5mL10%NaOH溶液,使漏斗柄插入液面下2~3cm,整个操作过程中漏斗下端不能露出液面。小试管的橡皮塞要切去一个缺口,使试管内与锥形瓶相通。加热样品溶液,开始时用大火加热,溶液开始沸腾时改为小火,保持微沸状态。蒸出的氨通过导管被标准HCl溶液吸收。约1h左右可将氨全部蒸除。取出并拔掉插入HCl溶液中的导管,用少量水将导管内外可能沾附的溶液洗入锥形瓶内。用标准NaOH溶液滴定过量的HCl(以甲基红为指示剂)。根据加入的HCl溶液体积及浓度和滴定所用NaOH溶液体积及浓度,计算样品中氨的含量。
图:测定氮的装置
此过程中反应方程式:
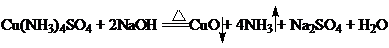
按下式计算NH3含量:
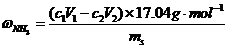
4. SO42-的测定 用重量法分析SO42-含量。
准确称取在100~200℃干燥过的试样0.3g左右两份,分别置于400mL烧杯中,用水50mL溶解,加入2mol∙L-1盐酸6mL,加水稀释到约200mL,盖上表面皿加热近沸。
另取10%氯化钡溶液10mL两份,分别置于100mL烧杯中,加水40mL,加热至沸。在不断搅拌下,趁热用滴管吸取稀氯化钡溶液,逐滴加入试液中,沉淀作用完毕后,静置2min,待硫酸钡下沉,于上层清液中加1~2滴氯化钡溶液,仔细观察有无浑浊出现,以检验沉淀是否完全,盖上表面皿微沸10min,在室温下陈化12小时,以使试液上面悬浮微小晶粒完全沉下,溶液澄清。
过滤:取中速定量滤纸两张,按漏斗的大小折好滤纸使其与漏斗很好地贴合,以去离子水润湿,并使漏斗颈内留有水柱,将漏斗置于漏斗架上,漏斗下面各放一只清洁的烧杯,利用倾泻法小心地把上层清液沿玻璃棒慢慢倾入已准备好的漏斗中,尽可能不让沉淀倒入漏斗滤纸上,以免防碍过滤和洗涤。当烧杯中清液已经倾注完后,用热水洗沉淀4次(倾泻法),然后将沉淀定量转移到滤纸上,再用热水洗涤7~8次,用硝酸银检验不显浑浊(表示无氯离子)为止。沉淀洗净后,将盛有沉淀的滤纸折叠成小包,移入已在800℃灼烧至恒重的瓷坩埚中烘干,灰化后再置于800℃的马弗炉中灼烧1小时,取出,置于干燥器内冷却至室温、称量。根据所得硫酸钡量,计算试样中w(SO42-)。
五、数据记录与处理.
1.铜含量的测定
(a)以波长λ为横坐标,吸光度(A)为纵坐标,绘制[Cu(NH3)4] 2+的吸收曲线,求最大吸收波长λmax
| λ/nm |
500 |
520 |
540 |
560 |
580 |
| A(2.00mL) |
|
|
|
|
|
| A(4.00mL) |
|
|
|
|
|
| λ/nm |
500 |
520 |
540 |
560 |
580 |
| A(2.00mL) |
|
|
|
|
|
| A(4.00mL) |
|
|
|
|
|
(b)以Cu2+溶液体积为横坐标,吸光度为纵坐标,绘制标准曲线。
| V/mL |
0.0 |
1.0 |
2.0 |
3.0 |
4.0 |
5.0 |
样品 |
| A |
|
|
|
|
|
|
|
(c)在标准曲线上求Cu2+含量,进而计算样品中铜的含量。
2.氨含量的测定
(a)根据加入标准HCl溶液的体积及浓度和消耗的标准NaOH溶液体积及浓度计算氨的百分含量。
(b)根据所称取的样品质量计算吸收氨所需标准HCl的理论量。若要求回滴时消耗标准NaOH溶液为20mL左右,则可计算实际应取标准HCl溶液的体积(单位mL)。例如,样品的质量为0.1500g,则应取标准HCl溶液45.0mL。
3. SO42-含量的测定
| 编号 实验项目 |
|
|
| 倾出前(称量瓶+试样)质量 倾出后(称量瓶+试样)质量 取出试样的质量W |
|
|
| (BaSO4+坩埚)质量 |
1) 2) |
1) 2) |
| 坩埚质量 |
1) 2) |
1) 2) |
| 滤纸灰份质量 |
|
|
| BaSO4质量 |
|
|
| w(SO42-) |
|
|
| w(SO42-)平均值 |
|
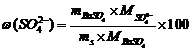
4. 将测得Cu2+、SO42-、NH3含量与理论值比较,分析误差产生的原因。
六、注意事项:
1. 要制得比较纯的[Cu(NH3)4]SO4.H2O晶体,必须注意操作顺序,CuSO4要尽量研细,且应充分搅拌,否则可能局部生成Cu2(OH)2SO4,影响产品质量(反应后溶液应无沉淀,透明)。
2. [Cu(NH3)4]SO4.H2O生成时放热,在加入乙醇前必须充分冷却,并静置足够时间。如能放置过夜,则能制得较大颗粒的晶体。
3. 废液和固体废弃物倒入指定容器中。
七、思考题
1.试拟出测定硫酸四氨合铜中SO42-含量的实验步骤。
2. 硫酸四氨合铜中Cu2+,NH3和SO42-喊可以用哪些方法测定?