实验类型: 验证 要求:必修 学时:4
教学重点及难点:EDTA的标定方法、指示剂的选择、水的硬度的测定方法
一、实验目的
1.了解EDTA标准溶液的配制和标定原理;了解水的总硬度的表示方法;
2. 掌握常用的标定EDTA的基本原理及方法;学习络合滴定法的原理及其应用。
3. 掌握络合滴定法中的直接滴定法。
二、实验原理
乙二胺四乙酸二钠简称EDTA,由于EDTA与大多数金属离子形成稳定的1:1型螯合物,故常用作配合滴定的标准溶液。EDTA常因吸附约0.3%的水分和其中含有少量杂质而不能直接用做标准溶液。
用于标定EDTA溶液的基准物质有Zn, Cu,Bi,Ni,Pb等含量不低于99.95%的某些金属以及它们的金属氧化物ZnO或某些盐类,如ZnSO4·7H2O,CaCO3, MgSO4·7H2O等。通常选用的标定条件应尽可能与测定条件一致,以免引起系统误差,如果用被测元素的纯金属或化合物作基准物质,就更为理想。
常见用纯金属锌作基准物标定EDTA,可以用铬黑T作指示剂,用氨缓冲溶液,在pH=10进行标定。也可用二甲酚橙作指示剂,用六亚甲基四胺调节酸度,在pH=5~6进行标定。
EDTA的特点:
a. 配位能力强;氨氮和羧氧两种配位原子;
b. 多元弱酸;EDTA可获得两个质子,生成六元弱酸;
c. 与金属离子能形成多个多元环,配合物的稳定性高;
d. 与大多数金属离子1∶1配位, 计算方便;
含有钙镁盐类的水叫硬水(硬度小于5.6度的一般可称软水)。硬度有暂时硬度和永久硬度之分。凡水中含有钙、镁的酸式钙酸盐,遇热即成钙酸盐沉淀而失去其硬度则为暂时硬度;凡水中含有钙、镁的硫酸盐、氯化物、硝酸盐等所成的硬度称为永久硬度。
暂时硬度和永久硬度的总和称为“总硬”。由Mg2+离子形成的硬度称为“镁硬”,由Ca2+离子形成的硬度称为“钙硬”。
水的硬度表示方法有多种,目前我国采用二种表示方法:一种是以CaO的mmol∙L-1计,表示1L水中所含CaO的mmol数,其硬度表示为
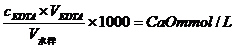
另一种表示方法是以度°计,1硬度单位表示十万份水中含一份CaO,1°=10ppmCaO,即1L水中含10mgCaO其硬度表示为:
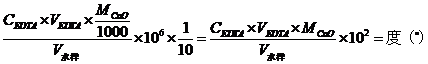
式中 CEDTA—EDTA标准溶液的浓度 mol∙L-1;
VEDTA—滴定时用去的EDTA标准溶液的体积,若为滴定总硬时所用去的,则所得硬度为总硬;若为滴定钙硬时用去的体积,则所得硬度为钙硬;
V水样—水样的体积(mL)。
水中钙镁离子含量,可用EDTA法测定总硬度,测定时控制溶液的酸度为pH≈10,铬黑T为指示剂,以EDTA标准溶液滴定水中Ca2+、Mg2+,由EDTA浓度和用量,可计算出水的总硬度。钙硬是在溶液pH≥12时,以钙指示剂作为指示剂,用EDTA标准溶液滴定水中Ca2+,由EDTA浓度和用量,可算出水钙硬,由总硬度减去钙硬即为镁硬。
在pH≈10的氨性缓冲溶液中,以铬黑T为指示剂,用三乙醇胺和Na2S掩蔽Fe 3+、Al 3+、Cu 2+、Pb 2+、Zn 2+等干扰离子,用EDTA标准溶液滴定至蓝色为终点。所得Ca、Mg总量折算成CaO的量来表示总硬度的大小。
三、主要试剂与仪器
1、乙二胺四乙酸二钠(Na2H2Y·2H2O,相对分子质量372.2);2、CaCO3(A.R.)基准物质;3、0.5%铬黑T指示剂;4、甲基红;5、1:1的盐酸;6、1:2氨水;7、NH3·H2O-NH4Cl缓冲溶液(pH≈10);8、电子天平;9、移液管;10、容量瓶;11、滴定管;12、表面皿
四、实验步骤
1、以CaCO3为基准物质标定0.01 mol·L-1EDTA标准溶液:
准确称取CaCO3 0.09~0.1g左右置于50mL烧杯中,少量水润湿,加入5mL(1:1)HCl,盖上表面皿溶解,定容于100mL容量瓶。
2. EDTA标准溶液浓度的标定
用铬黑T作指示剂。移取10mL试样三份,加1滴甲基红,用氨水中和溶液至稳定的黄色,再补加20mL水,5mLMg-EDTA,10mLNH3-NH4Cl缓冲液,3滴铬黑T,用EDTA滴定至纯蓝色为终点。
3.自来水的总硬的测定:
准确量取澄清的水样10mL于锥形瓶中,加入1~2滴1:1HCl使之酸化,并煮沸数分钟除去CO2,冷却后加入1:2三乙醇胺5mL, pH≈10氨性缓冲溶液5mL,1~3滴铬黑T,摇匀,用EDTA标准溶液滴定,溶液由紫红色转变为纯蓝色即为终点,记下消耗EDTA体积V1。
五、数据记录与处理
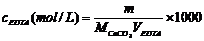
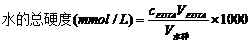
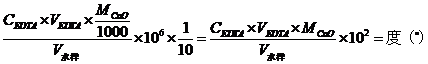
| 实验号码 记录项目 |
Ⅰ |
Ⅱ |
Ⅲ |
| m(CaCO3)/g |
|
| V CaCO3/mL |
|
|
|
| V1 EDTA/mL |
|
|
|
| cEDTA(mol/L) |
|
|
|
| 平均值cEDTA(mol/L) |
|
| V水样/mL |
|
|
|
| V 2EDTA/mL |
|
|
|
| 水的总硬度(mmol/L) |
|
|
|
| 水的总硬度的平均值(mmol/L) |
|
| 水的总硬度(°) |
|
|
|
| 水的总硬度的平均值(°) |
|
|
|
| 相对偏差/% |
|
|
|
| 平均相对偏差/% |
|
|
|
六、注意事项:
1. 络合反应速度较慢,滴定时滴加速度不能太快,特别是临近终点时,要边滴边摇晃。
2. 注意比较不同标定方法的差异,想想为什么要用不同的方法标定EDTA。
3.以CaCO3为基准物质标定时加入Mg-EDTA的作用是什么?基于什么原理?
4.若水样不清,则必须过滤,过滤所用的器皿和滤纸必须是干燥的,最初的滤液须弃去。
5.若水中含有铜、锌、锰、铁、铝等离子,则会影响测定结果,可加入1%Na2S溶液1mL使Cu2+、Zn2+等成硫化物沉淀,过滤。锰的干扰可加入盐酸羟胺消除。
6.在氨性液中,Ca(HCO3)2含量较高时,可能慢慢析出CaCO3沉淀,使滴定终点拖长,变色不敏锐,所以滴定前最好将溶液酸化,煮沸除去CO2,注意HCl不可多加,否则影响滴定时溶液的pH值。
七、思考题:
1.为什么要使用两种指示剂分别标定EDTA?
2.在中和标准物质中的HCl时,能否用酚酞取代甲基红?为什么?
3.阐述Mg2+-EDTA能够提高终点敏锐度的原理。
4.滴定为什么要在缓冲溶液中进行?如果没有缓冲溶液存在,将会导致什么现象发生?
各种金属离子与滴定剂生成络合物时都应有允许最低pH值,否则就不能被准确滴。而且还可能影响指示剂的变色点和自身的颜色,导致终点误差变大,甚至不能准确滴定。因此酸度对络合滴定的影响是多方面的,需要加入缓冲溶液予以控制。
5.本节使用的EDTA应采用何种指示剂标定?最适当的基准物质是什么?
6.在测定水的硬度时能否先将三份试样一起准备好后,再分别滴定?
7.写出以ρCaCO3(单位为mg/L)表示水的总硬度的计算公式,并计算实验中水样的总硬度。
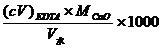 (mg·L-1)
(mg·L-1)