——数据的表达与处理
一、实验目的
1、 了解浓度、温度、催化剂对反应速度的影响,测定过二硫酸铵与碘化钾反应的反应速度,并计算反应级数、反应速度常数和反应的活化能;
2、学会实验数据的表达与处理。
二、实验原理
S2O82-+3I-=====2SO42-+I3-
υ=kC S2O82- mCI-n
υ=-ΔC S2O82- /Δt
2S2O32-+I3-====S4O62-+3I-
因此:υ=-ΔC S2O82- /Δt=-1/Δt×C S2O32-/2
三、基本操作
1、量筒的使用;
2、计量——秒表的使用;
3、作图方法。
四、实验内容
1、浓度对化学反应速率的影响;
2、温度对化学反应速率的影响;
3、催化剂对化学反应速率的影响。
五、数据处理
1、反应级数和反应速率常数的计算:
lgυ==m lgCS2O82-+nlgCI-+lgk
当CI-不变时(即实验Ⅰ、Ⅱ、Ⅲ),以lgυ对lgCS2O82-作图,可得一条直线,斜率为m。同理,当CS2O82-不变时(即实验Ⅰ、Ⅳ、Ⅴ),以lgυ对lgCI-作图,可得一条直线,斜率为n。此反应的级数则为m+n。
将求得的m和n代入υ==kCS2O82-mCI-n即可求得反应速率常数k。
2、反应活化能的计算
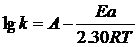
六、问题及注意事项
本实验拟采取先做后归纳的方式,课前提出问题,核心是两人如何亲密合作准确测定:
(1)两人一个组,量筒数量及量程有限,如何合理使用取用6种试剂?用多大容器作为反应容器?(准备标签纸)越大越好吗?
(2)怎样确保加入了全部试剂?怎样提高效率?
(3)为什么先加KI后加(NH4)2S2O8,反之呢?
为什么要迅速加入(NH4)2S2O8?
加入KNO3或(NH4)2S2O8的目的呢?二者参与反应了吗?
(4)如何精确计时?
(5)如何作好温度对υ的影响?
1°用大烧杯作水浴锅,药品装在什么容器中?
2°测定水浴或溶液的温度,还是空气的温度?如何测?
3°就现有条件如何保证水浴温度恒定?
4°反应开始后将反应液从水浴中取出吗?
(6)溶液出现蓝色后,反应是否就终止了?