一、实验目的
1.了解pH法测定醋酸解离度和解离常数的原理。
2.学习pH计使用方法,进一步练习滴定管、移液管等基本操作。
二、预习内容
1.吸管、移液管和容量瓶的正确使用。
2.酸碱滴定管的正确使用。
3.如何控制终点前的半滴操作。
4.酸度计的正确使用。
三、实验原理
醋酸是一元弱酸,在水溶液中存在着下列平衡:
HAc(aq) = H+ (aq) + Ac- (aq)
开始浓度 /mol·dm-3 c 0 0
平衡浓度 /mol·dm-3 c -cα cα cα
其解离常数表达式:
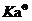 =
= 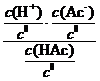 =
= 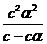 =
= 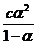 ≈ cα2
≈ cα2
α为醋酸的解离度。
在一定温度时,用pH计测定一系列已知浓度的醋酸的pH值,再按pH= -lg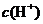 ,求出
,求出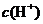 。根据
。根据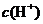 = cα,即可求得一系列的HAc的α和
= cα,即可求得一系列的HAc的α和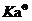 值,取其平均值即为在该温度下HAc的解离常数。
值,取其平均值即为在该温度下HAc的解离常数。
四、实验仪器和药品
1.仪器
pHS-25型酸度计、气流烘干器、50cm3酸式滴定管两支、50cm3碱式滴定管一支、100cm3烧杯四只、250cm3锥形瓶两只、25cm3移液管一支、玻璃棒、0℃~100℃温度计一支(公用)、铁架、滴定管夹、吸气橡皮球、洗瓶、滤纸。
2.药品
① HAc溶液(约0.1mol·dm-3)
② 标准NaOH溶液(约0.1mol·dm-3,4位有效数字)
③ 酚酞(1%)
五、实验内容及操作步骤
1.醋酸溶液浓度的标定
用移液管移取2份25cm3 0.1mol·dm-3 HAc溶液,分别注入2只锥形瓶中,各加2滴酚酞。分别用标准NaOH溶液滴定至溶液刚出现粉红色,轻轻摇荡后半分钟不褪色为止。记下滴定前和滴定后碱式滴定管读数,算出醋酸溶液的精确浓度。
公式:c(HAc)·V(HAc)= c(NaOH)·V(NaOH)
2.配制不同浓度的HAc溶液
在四只干燥的100cm3烧杯中(编号为1、2、3、4),用酸式滴定管分别加入已标定的HAc溶液于1号杯48.00cm3,2号杯24.00cm3,3号杯12.00cm3,4号杯6.00cm3。再从另一盛有去离子水的滴定管往2、3、4号杯中分别加入24.00cm3、36.00cm3、42.00cm3去离子水,并混合均匀待测。
3.溶液pH值的测定
用酸度计分别测定上述各种浓度的HAc溶液(由稀到浓)的pH值(酸度计的使用参见附:LpH-802中文台式酸度计操作步骤),并记录每份溶液的pH值及测定时的室温。
六、实验数据的记录与处理
1.HAc浓度的标定
c(NaOH)= mol·dm-3

| 编号 |
HAc体积(cm3) |
滴定管起始读数(cm3) |
滴定管终了 读数(cm3) |
消耗NaOH 体积(cm3) |
c (HAc) (mol·dm-3) |
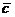 (HAc) (HAc)
(mol·dm-3) |
| 1 |
| 25.00 |
|
|
|
|
|
| 2 |
25.00 |
|
|
|
|
|
2.HAc溶液的pH值及解离常数
| 编号 |
HAc体积(cm3) |
H2O体积(cm3) |
HAc浓度 (mol·dm-3) |
pH值 |
c (H+) (mol·dm-3) |
解离度 α |
解离常数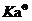 = cα2 = cα2 |
| 1 |
48.00 |
0.00 |
|
|
|
|
|
| 2 |
24.00 |
24.00 |
|
|
|
|
|
| 3 |
12.00 |
36.00 |
|
|
|
|
|
| 4 |
6.00 |
42.00 |
|
|
|
|
|
3.计算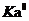 的平均值
的平均值
溶液T = ℃
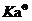 (平均)=
(平均)=
七、注意事项
1.平行滴定时指示剂的用量要一致;
2.滴定操作要规范,要控制好终点前的半滴操作;
3.测量pH值之前,烧杯必须洗涤并干燥;
4.复合电极要轻拿轻放,避免损坏;
5.测定不同浓度醋酸溶液的pH值时,宜按由稀到浓的顺序测定。
附: LpH-802中文台式酸度计操作步骤
1. 装配:请按如下图示装配酸度计。
2. 通电预热30分钟;
3. 按“退出”键进入主菜单,按“︽、︾”键将光标移到“标定”项,按“确认”键进入标定方法选择界面,按“︽、︾”键选择“两点标定”,按“确认”键即可按如下步骤进行标定:
|
|
|
|
|
|
|
06年01月02日标定结果:
E0=xx.xx 误差:X.XXpH
S=x.xxx 误差:XX.XX%
存储完毕
|
|
|
如选择“合格”,标定的结果自动存储,三秒钟后显示消出,进入测量态。在“E0.S值查询”和“参数”菜单中可查询到。如选“失败”,将退到“标定”子菜单。
|
|
|
|
|
 |
4. 将电极插入装有被测水样的烧杯中,(注意不要接触杯壁或杯底)水样稳定后,即可读数。
5. 测量完毕后,取出复合电极,用蒸馏水淋洗电极,套上复合电极帽,并关闭电源。