实验十、常见离子鉴定
一、实验目的:
1. 巩固和进一步掌握一些金属元素及其化合物的主要性质;
2. 了解常见阳离子混合液的分离和检出方法;
3. 巩固离子检出的操作。
二、实验内容
1、 实验原理
离子的分离和鉴定是以各离子对试剂的不同反应为依据的。这种反应常伴随有特殊的现象,如沉淀的生成或溶解,特殊颜色的出现,气体的产生等等。
各离子对试剂作用的相似性和差异性都是构成离子分离与检出方法的基础。也就是说,离子的基本性质是进行分离检出的基础。因而要想掌握分离检出的方法就要熟悉离子的基本性质。
离子的分离和检出只有在一定条件下才能进行。所谓一定的条件主要指溶液的酸度、反应物的浓度、反应温度、促进或妨碍此反应的物质是否存在等。为使反应向期望的方向进行,就必须选择适当的反应条件。
因此,除了要熟悉离子的有关性质外,还要学会运用离子平衡(酸碱、沉淀、氧化还原、络合等平衡)的规律控制反应条件。这对于我们进一步了解离子分离条件和检出条件的选择将有很大帮助。
用于常见阳离子分离的性质是指常见阳离子与常用试剂的反应及其差异,重点在于应用这种差异性将离子分离。
2、仪器与试剂
①仪器
试管,离心试管,点滴板,滴管,煤气灯,水浴烧杯,离心机等。
②药品:
浓度均为0.1mol·L-1的阴离子混合液:CO32-,SO42-,NO3-,PO43-一组;Cl-,Br-,I-一组;S2-,SO32-,S2O32-,CO32-一组;未知阴离子混合液可配5-6个离子一组。
3、实验内容:
(一)常见阳离子的分离与鉴定
1、NH4+的鉴定


2.Na+的鉴定
①用饱和六羟基锑(V)酸钾KSb(OH)6溶液
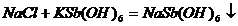
假若没有沉淀,可以摩擦试管内壁
②用醋酸铀酰锌与Na+在醋酸缓冲溶液中生成淡黄色结晶状醋酸铀酰锋钠沉淀:
3、K
+
的鉴定:
1)用饱和洒石酸氢钠NaHC4H4O6

2)焰色反应
钾离子在氧化焰中灼烧,火焰呈紫色。
4、Mg2+的鉴定
用镁试剂:

Mg2+与镁试剂工在碱性溶液中生成蓝色螯合物沉淀
5、Ca2+的鉴定(用草酸铵)
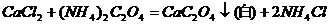
6、Ba2+的鉴定:用K2CrO4溶液在HAc和NaAc缓冲液中
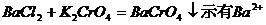
7、Al3+的鉴定,用HAC酸化的铝试剂
8、Fe
3+
的鉴定:含Fe
3+
试剂 加0.25mol/L
k
4
Fe(CN)
6
一滴
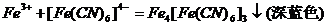
9、Fe2+的鉴定:含Fe2+试剂 加0.25mol/Lk3Fe(CN)6一滴

10. Sn2+的鉴定

11、Cu 2+的鉴定:
12、Pb
2+
的鉴定
(二)常见阴离子的鉴定
1、 的鉴定:
的鉴定:
测定0.1mol.L-1的Na2CO3溶液的PH值
向Na2CO3溶液中加入10滴6mol.L-1的HCl
用玻璃棒蘸石灰水检验生成的气体
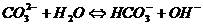
2、 的鉴定:
的鉴定:
(1)加硫酸铁和硫酸:
3Fe2+ + NO3- + 4H+ === 3Fe3+ + NO + 2H2O
[Fe2+(H2O)6]2+ + NO === [Fe2+(NO)(H2O)5]2+ (棕色) + H2O


 (2)NO3-的鉴定:再加入少量锌粉
(2)NO3-的鉴定:再加入少量锌粉




 取混合试液
取混合试液

 原理:2NO3--+6HAc+Zn=2HNO2+Zn2+6Ac-+2H2O
原理:2NO3--+6HAc+Zn=2HNO2+Zn2+6Ac-+2H2O


 2HNO2+H2N- -SO3H+
2HNO2+H2N- -SO3H+

3、 的鉴定
的鉴定
取2滴 试液于点滴板上,加1滴2mol.L-1的HAc,再加一滴对氨基苯横酸和1滴α—胺如有玫瑰红色出现,溶液呈红色偶氮染料,示有
试液于点滴板上,加1滴2mol.L-1的HAc,再加一滴对氨基苯横酸和1滴α—胺如有玫瑰红色出现,溶液呈红色偶氮染料,示有 存在。
存在。
4、
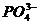 的鉴定
的鉴定
(1)用AgNO3溶液

(2)用(NH4)2MoO4

5、 的鉴定
的鉴定
取5滴 ,加2滴6mol.L-1的HCl和1滴
,加2滴6mol.L-1的HCl和1滴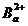 溶液,如有白色沉淀,示有
溶液,如有白色沉淀,示有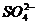 存在
存在
6、 的鉴定:用KMnO4酸性溶液
的鉴定:用KMnO4酸性溶液
5SO32- + 2 MnO4- + 6H+ === 5SO42- + 2Mn2+ + 3H2O
紫色褪去,示有SO32-存在。
7、S2O32的鉴定(用AgNO3溶液)
2Ag+ + S2O32- ===Ag2S2O3↓(白色沉淀)
Ag2S2O3 + H2O=== Ag2S↓ + H2SO4
白色沉淀迅速变棕变黑,示有S2O32-存在
8、S2-的鉴定:用亚硝酸铁氰化钠
 红紫色
红紫色
9、Cl-的鉴定:用硝酸酸化的AgNO3溶液和氨水
Ag+ + Cl-=== AgCl↓ 白色沉淀
AgCl + 2NH3·H2O ==== [Ag(NH3)2]Cl + 2H2O
[Ag(NH3)2]Cl + 2HNO3 === AgCl↓ + 2NH4+ + 2 NO3-
10、I-的鉴定(用酸化氯水和CCl4)
2I- + Cl2 === I2 + 2Cl- (CCl4层呈现紫红色)
I2 + 5C12 + 6H2O === 2HIO3 + 10HCl (CCl4层的紫红色褪至无色)
11、Br-的鉴定(用酸化的氯水)
2Br- + Cl2 ===Br2 + 2Cl-
CCl4层出现黄色或橙红色,示有Br-存在。
(三)混合离子的分离和鉴定
1. Ag+、Cd2+、Al3+、Ba2+、Na+的分离和鉴定
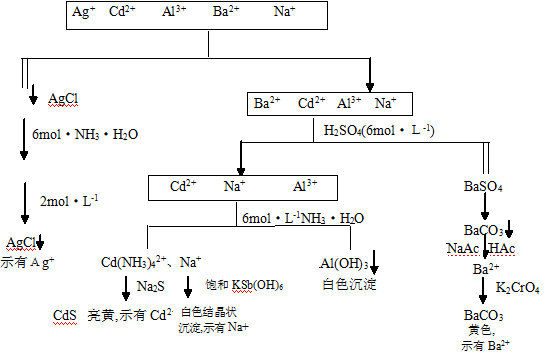
2、 混合液的分离和鉴定
混合液的分离和鉴定
设计方案如下:
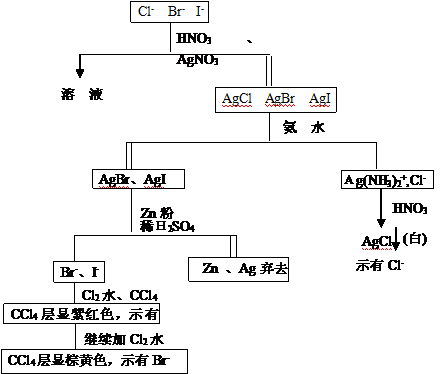
3、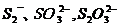 混合物的分离和鉴定
混合物的分离和鉴定

4、结果与记录
三、思考题解答
1.取下列盐中之两种混合,加水溶解时有沉淀产生。将沉淀分成两份,一份溶于HCl溶液,另一份溶于HNO3溶液。试指出下列哪两种盐混合时可能有此现象?
BaCl2、AgNO3、Na2SO4、(NH4)2CO3、KCl
答:BaCl2、(NH4)2CO3。
2.一个能溶于水的混合物,已检出含Ag+和Ba2+。下列阴离子中哪几个可不必鉴定?
SO32-、Cl-、NO3-、SO42-、CO32-、I –
答:NO3-
4.加稀H2SO4或稀HCl溶液于固体试样中,如观察到有气泡产生,则该固体试样中可能存在哪些阴离子?
答:较常见的可能有:CO32-, SO32-, S2O32-, S2-,O22-等。
5.有一阴离子未知液,用稀HNO3,调节其至酸性后,加入AgNO3试剂,发现并无沉淀生成,则可以确定哪几种阴离子不存在?
答:可以确定不存在的较常见离子有:Cl-, Br -, I-, SO42-, S2-等。
6.在酸性溶液中能使I2--淀粉溶液褪色的阴离子是哪些?
答:最常见的有MnO4-, Cr2O72-, S2O82-, Cl-, Br-, O22- 等较强的氧化剂。